Como estamos acompanhando, ao longo dos últimos 2 anos, o foco tem se deslocado das N-nitrosaminas clássicas para as NDSRIs. E, pelo que estamos vendo, o desafio é tanto para reguladores quanto para regulados. As orientações regulatórias têm sido periodicamente atualizadas à medida que o entendimento científico evolui (Formation of N-Nitrosamine Drug Substance Related Impurities in Medicines: A Regulatory Perspective on Risk Factors and Mitigation Strategies).
Recentemente, houve a publicação de modelo de análise para NDSRIs (EMA/409815/2020 Rev.16). Isto, de certa forma, traz implicações para o cenário regulatório do brasileiro. Um resultado possível é a necessidade alinhamento/harmonização.
Segundo o EMA/409815/2020 Rev.16, temos:
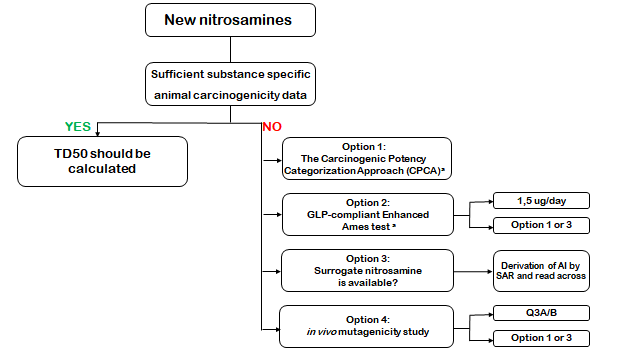
Pela revisão mais recente do Guia nº 50/2021 – versão 3, ANVISA, temos:
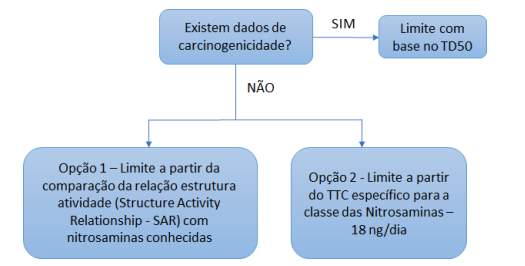
Observação: esta revisão ocorreu anteriormente à publicação do Q&A do EMA.
Bom, o alinhamento pode resultar em uma maior harmonização regulatória, reduzindo barreiras ao comércio e facilitando a disponibilidade oportuna de medicamentos seguros e eficazes no mercado brasileiro.
Diante dessa perspectiva, surge a questão: como você acha que a regulamentação do Brasil será alterada/adaptada em vista da recente revisão da legislação internacional?