Thank you, Yosuke! Very promising agenda and list of lecturers! Looking forward to reading/listening the presentations!
米国薬局方(USP)-MHLW/PMDA共同ワークショップ
米国薬局方(USP)-MHLW/PMDA共同ワークショップについてお知らせします。
日時
2024年9月10日(火曜日)12時30分から17時00分
2024年9月11日(水曜日)9時30分から14時15分
開催方法
ウェブ配信を含むハイブリッド開催
参加費
無料
ニトロソアミンに関するところは以下の部分です。
9/11 11時15分から13時30分
セッション4 ニトロソアミンに係るアップデートについて
・Nitrosamines - Past, Present and Future
Naiffer(USP)、Mrunal(USP)
・Approaches and considerations for N-nitrosamine issues from a quality perspective
長遠裕介(富士フイルム富山化学株式会社 富山研究開発センター)
・Past, Present & Future - current regulation on Nitrosamines in Japan
宮坂知幸(厚生労働省)
レギュラトリーサイエンスのエキスパート研修会で、ニトロソアミン問題に関するウェビナーを開催します。
https://www.pmrj.jp/kenshu/html/files/yakuji/576/E295.pdf
タイトル:医薬品のニトロソアミン類混入リスクへの品質対応(2024)
-今後の効果的実践に向けて協働して取り組む-
日時: 2024年9月17日(火) 13:00~17:00
プログラム
|時間 | 講演 | 演者|
|13:00~13:05 | 挨拶 | 奥田 晴宏氏(レギュラトリーサイエンス財団会長)|
|13:05~13:30 | ニトロソアミン類のリスク評価・管理の概要と課題 |美濃 洋祐(JT、Nitrosamine Exchange Ambassador)|
|13:30~13:50 | ニトロソアミン類対応の動向、対応の実践と課題 -安全性の観点から- | 橋本 清弘氏(製薬協不純物TF、武田薬品工業)|
|13:50~14:20 | ニトロソアミン類のリスク評価に関する意見収集結果、及び実践と課題 | 平井 康夫氏(ダイト株式会社)|
|14:30~14:55 | 添加剤における亜硝酸の管理について | 松本 洋典氏(旭化成株式会社)|
|14:55~15:20 | ニトロソアミン類の品質対応の実践 -分析の観点で- |近藤 加奈子氏(東和薬品株式会社) |
|15:20~15:50 | ニトロソアミン類の規制動向、及びアンケートの評価、並びに期待事項-当局の観点で | 桝田 昂志氏(厚生労働省監麻課)|
|16:00~17:00 | 質疑応答・パネルディスカッション | 講師全員 四方田 千佳子氏(国衛研)|
微力ながら私も講演させていただきます。日本国内の自主点検の期限(2024年10月末)が近づいてきていることから、少しでも多くの方にお話をお聞きいただいて、できる限り心配事を解消いただきたいと考えております。
よろしくお願いいたします。
日医工社製のアトモキセチンカプセル40mgの自主回収(クラスII)について、PMDAのホームページに情報が公開されたのでお知らせします。
原薬の製造工程にて、窒素酸化物を多く含んだ空気が作業室中に流入し、アトモキセチンと反応したと考えられているそうです。なお、原薬の設備変更により、原薬中のニトロソアミン量は低値傾向を示しており、回収対象外のロットのニトロソアミン混入量は許容限度値(100ng/day)以下となっているとのことです。
7/25の日刊薬業の記事についてお知らせします。
ニトロソアミン点検「10月末完了難しい」 沢井製薬、NDSRI対応などが理由
以下,要点まとめ
・沢井製薬ではニトロソアミンの国内自主点検の期限である10月末に,対応を完了するのが難しいという見解
・750品目中,低分子ニトロソアミンは大半がリスクなし リスクありのものについては実測中
・NDSRIについて追加で対応中。
・ニトロソアミンの予測技術である「ノクサナ」とニトロソアミンの生成を抑える添加剤「サプレナ」を開発,特許出願中。
・ノクサナは文献が公開されている,反応性NOxを用いた予測技術,サプレナは酸化防止剤以外の反応防止剤だそうです。
沢井製薬のホームページに情報が公開されています。
@Yosukemino tha la for sharing the latest developments in Japan… anywhere we could learn more about Noxera? The predictions tool? Sounds very interesting
I appreciate your interest, @Naiffer_Host. Details will be disclosed after the patent is granted. According to the Sawai homepage, Noxana has a database of excipients with the amount of reactive NOx. The amount of reactive NOx is determined by measuring nitrosamines generated through amine addition, such as DMA, under stress conditions. It’s a similar approach to calculating the amount of nitrite in excipients.
2024年7月17日にあった、第9回 ニトロソアミンのリスク評価に関するグループ討議(オンライン)での情報をざっくりと共有します。
- Nitrogen Oxides in Air as a Source of Nitrosamines in Drugs(Dr. Grahek, Sandoz)の紹介
・大気中のNOxガスの,添加剤への混入について
・医薬品製造時のNOxガス混入事例について
・NOとNO2のニトロソアミン生成量の比較,二級アミン及び二級アミン塩酸塩とNOxガスの接触実験の結果について
Q&AのQ抜粋
Q. 添加剤が大気中のNOxを吸収するのであれば,添加剤中の亜硝酸量を測定しても,保存中に変動する懸念があるのではないか?
Q. 二級アミン塩酸塩の反応性が低かった理由は?
- 添加剤製造における亜硝酸の管理(Asahi Kasei)
・旭化成のMCC中の亜硝酸量の管理について
・MCC中の亜硝酸量の高感度分析法について
・添加剤中の亜硝酸混入量と水分量に関する考察
Q&AのQ抜粋
Q. 亜硝酸量が少ないMCCを製造する上での要点は何か?
Q. 亜硝酸量を増加させないためには,MCCの保管方法をどうすればよいか?
Q. 今後の日本の添加剤業界の取り組みは?
- Aptar CSP Technologies 機能性ソリューションのご紹介(Aptar CSP Technologies)
・NOxやニトロソアミンを減らす機能性包装材料について
・様々な機能性担体の効果について
・導入後の検討の進め方について
Q&AのQ抜粋
Q. 他社の導入事例はどうなっているか?
Q. 文献等で情報公開の予定はあるか?
-
日刊薬業の最近の記事まとめ
・ニトロソアミンの自主点検に関するアンケートについて
・ニトロソアミンのICH M7でのトピック化について
・ニトロソアミンのリスクコミュニケーションガイダンスについて -
その他自由討議
Q. ニトロソアミンが許容限度値の10-30%で検出された場合,如何に対応すべきか?(通知に記載がない部分は製薬企業がケースバイケースで対応することになるが,正解はあるのか?)
Hi @Yosukemino,
Thanks for the always useful news you share. By any chance is there any slides or maybe further input you could give the NOx topic?
Thanks in advance.
Hi @Diego_HM,
Thank you for your inquiry. I send you a brief memo of the discussion later.
日本国内の「医薬品におけるニトロソアミン類の混入リスクに関する自主点検について」 の実施期限延長についてお知らせします。
以下,本文からの抜粋です。
当該通知及び事務連絡では、製造販売業者に対し、自社が製造販売する品目について、ニトロソアミン類の既知の混入原因を参考に、ニトロソアミン類の混入リスクを評価すること、混入リスクのある品目について、ニトロソアミン類の含有量を測定し、限度値を超えるニトロソアミン類の混入が確認された品目については、規格値の設定、ニトロソアミン類の量を低減するための製造方法の変更等のリスク低減措置を令和6年 10 月 31 日までに講じることを求めています。 一方、ニトロソアミン類の新たな混入・生成ルートとして、医薬品添加剤に含まれる極微量の亜硝酸塩と有効成分等由来のアミン類との反応によりニトロソアミン類が生成するといった知見が得られ、リスク評価の再実施が必要となっています。更に、有効成分由来のニトロソアミン類(NDSRIs:nitrosamine drug substance-related impurities)では、標準物質の入手も含め測定系の確立に課題が生じている状況であり、期限内のリスク低減措置の実施が困難であることが明らかになっています。 今般、このような状況を踏まえ、令和6年10 月 31 日までとしていたリスク低減措置の実施期限を令和7年8月1日まで延長することとします。
Including google translation of the official notification… Thanks Yosuke!
001281613 (1).pdf (56.1 KB)
This is interesting.
Hasn’t it been previously shown that Hydrochloride salts were the most reactive for the formation of nitrosamines?
Dear @MarkS,
Thank you for asking. Dr. Grahek explained it as a solubility issue. Free secondary amines like DEA were liquid, while their hydrochloride salts were solid. The hydrochloride salts seem less available for reaction with atmospheric NO2 due to poor solubility in the air.
Best regards,
Yosuke
Here is a recommended reading to aid in our discussion:
Japan’s Regulatory Actions: On October 8, 2021, Japan’s MHLW mandated MAHs to self-inspect for nitrosamine contamination. The process involves:
- Step 1: Assessing contamination risk by April 30, 2023.
- Step 2: Evaluating nitrosamine levels in product lots at risk.
- Step 3: Implementing risk mitigation measures if nitrosamine levels exceed limits, with a deadline of October 31, 2024.
Current Status and Challenges: By March 2024, 80–90% of products had completed Step 2, with 10% deemed at risk. However, only 2–30% of items had been analyzed due to difficulties in setting acceptable limits, lack of data, and identifying nitrosamine formation pathways.
Industry Concerns: Many companies are worried about completing self-inspections by the deadline, with reported difficulties in the process (inadequate data available from manufacturers of additives, raw materials, and containers, and difficulties in identifying the pathways of nitrosamine
formation).
“Fundamentally, improving the manufacturing process is crucial for reducing the risk of nitrosamine formation. Reviewing the manufacturing method by optimizing solvents, reagents, and reaction conditions and ensuring operation under an inert atmosphere is important. Risk reduction can also be implemented by introducing new process technologies such as continuous manufacturing and fluidized bed reactions. Technological innovation is essential in addition to
regulations.”
The article raises several discussions, and I’d like to highlight this point (The Global Roadmap): addressing nitrosamine contamination involves not just regulatory compliance but also a broader strategy. Developing a global framework for safer, more effective medicines, supported by scientific evidence, is crucial for managing and mitigating these risks effectively.
Dear @MarkS and @lucas10mauriz,
Thank you for your discussion about nitrosamine risk assessment in Japan. I want to explain a summary of the recent updates in Japan.
- The deadline for Step 2 and 3 is approaching.
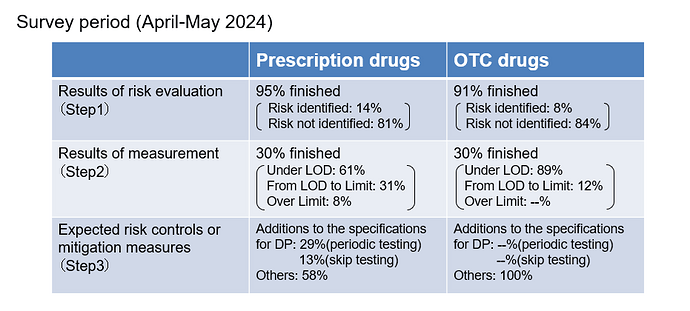
- Survey 1 (conducted in February 2024) revealed that the progress in Step 2 and 3 was not faster than anticipated.
- Survey 2 (conducted in April 2024) revealed that Japanese pharmaceutical companies plan to risk control measures for products with nitrosamine contamination in the future.
- The Japanese government responded to the survey results and extended the deadline for Step 2 and 3.
- The Japanese government published risk communication guidance for nitrosamine contamination beyond acceptable limits.
- The Japanese government will publish guidance about the application of pharmaceutical affairs including partial change application this fall.
The literature Lucas shared included the results of Survey 1. The article Marks shared included the results of Survey 2 and guidance about the application of pharmaceutical affairs. As far as I know, the details of the guidance have not been determined yet.
先日N-nitroso atomoxetineの混入に関するリスク評価について、医薬品等安全対策部会安全対策調査会での議論が公開されましたので、共有します。
資料3-1
要点
・日医工社が提案したN-nitroso atomoxetineの許容限度値はリードアクロス法による100ng/day(729ppb)
・日本イーライリリー社が提案したN-nitroso atomoxetineの許容限度値はin vivo試験のBMDLから算出した4400ng/day or 1500ng/day(M7におけるCohort of Concernに該当しない)
・当局の判断として、N-nitroso atomoxetineは警告構造を有し、Ames試験で陽性、in vivo試験でも陽性であることから、1500ng/day以上の許容限度値を設定することはできない また、in vivo試験での変異原性では許容限度値を設定できない 100ng/dayで管理するべき
・日医工社及び日本イーライリリー社のリスク評価文書については、資料3-2及び資料3-3参照
資料3-2(日医工社のリスク評価報告書)
要点
・日医工社のN-nitroso atomoxetineの測定値は原薬174ロットで15 ppbから5749 ppb(限度値729 ppb)
・原薬製造時のN-nitroso atomoxetine混入量の経緯:
中間体106 ppb→精製後762 ppb→粉砕後3444 ppb
・NOxガス濃度2 ppm環境下の実験室で、原薬をメノウ乳鉢で粉砕したところ、N-nitroso atomoxetine量が54 ppbから5247 ppbに増加した
・粉砕工程の実施場所変更により、N-nitroso atomoxetine混入量が明らかに減少した(最大5749 ppb→最大222 ppb等)
・旧粉砕場所では、空調の空気取り込み口付近にフォークリフト等が往来するスペースがあり、NOxを含む排気ガスが混入していたと考えられる(粉砕場所のNOx濃度の測定結果 旧粉砕場所(排気ガスの混入を想定): 8.4 ppm、新粉砕場所: 0.03 ppm未満)
・提案する低減措置・管理戦略:
- 粉砕時に環境中のNOx濃度を測定する
- 原薬について継続的に分析を行う(許容限度値を超えた場合は製造に使用しない)
- 苛酷試験(60℃2か月保管)により、保管による増加が許容できることを確認する
- 製剤での分析も検討する
資料3-3(日本イーライリリー社のリスク評価文書)
要点
・当局からの照会事項:発がん性データのないニトロソアミンについて、Ames 試験とTGR 試験が陽性となった場合、現在のガイダンス等では AI を 1500 ng/day より大きい値に設定することを許容していない。N-nitroso atomoxetineの TGR 試験におけるNOELやBMDLを発がん試験の NOEL や BMDL と同等に扱っている点は不適切。TGR 試験結果からの直接 AI 算出もICH M7(R2)で許容されていない。AI の再検討が必要
・日本イーライリリーの回答:
- ニトロソアミン類の既知の作用機序
- 物理的化学的特性に基づくリードアクロス(Jolly et al 2024)
- 量子力学モデル(De et al 2024)及び QSARFlex 等の In silico モデル(Jolly et al 2024)
- In vivo 遺伝子突然変異試験(Jolly et al 2024)
のWeight of Evidenceから4400ng/day及び1500ng/dayはそれぞれ適切
WoEよりN-nitroso atomoxetineが強い発がん性を示さないのは明白、少なくともCoCとみなすべきではない
Fascinating levels of increase due to the milling/grinding.
Begs the question around whether or not sample prep of tablets can cause an increase in the levels observed when tested.