Yosuke, do you know if the association will publish the final report of the findings? That will be a handy data set, similar to when EMA published the findings of all the Valsartan impact assessments.
Hi @Naiffer_Host,
The questionnaire will be sent directly to the Ministry of Health, Labour and Welfare, Japan. I am unsure how they publish the results, but it will be announced somehow. I guess additional measures will also be announced then or after that.
I’ll let you know if I find out anything.
要旨付きプログラムが公開されましたのでお知らせします。
日本の皆様 こんにちは
エンタカポンのNDEA混入で自主回収(クラスII)があったのでご連絡します。
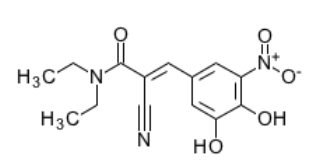
entacapone
https://www.info.pmda.go.jp/rgo/MainServlet?recallno=2-11655
【PDFからの抜粋】
NDEA は既知のニトロソアミン類であり、許容摂取量は 26.5 ng/日(エンタカポンの 1 日最大用量を 1600mg とした場合:0.0165 ppm)とされています。しかし、エンタカポンの累積治療期間は、比較的短い期間投与された後、トリプルコンビネーション製品を使用するのに便利なスタレボ治療に切り替えられるため、1 年未満であると考えられています。従って、ICH M7 に示される一生涯よりも短い期間(LTL:less-than-lifetime)のアプローチに基づき、最も保守的な調整係数(6.7×許容摂取量)を用いて算出した 177.55 ng/day(6.7×26.5 ng/day)を管理値として設定いたしました。
この暫定基準値(177.55 ng/day)を超えたP0001~P0003のロットについて自主回収が成されるそうです。
エンタカポン製剤のNDEA混入について、MHLWから更なる情報が公開されましたのでお知らせします。
エンタカポン製剤の使用による健康影響評価について
エンタカポン製剤におけるNDEAの検出及び発がんリスクに関する評価報告書
・ニトロソアミンなどの強⼒な変異原性発がん性物質については⽣涯曝露を想定した AI を⽤いることが⼀般的です。しかし,NDEA に対する AI については ICH M7 の⽣涯曝露よりも短い使⽤期間に従ったアプローチ(LTL:less-than lifetime)の適⽤可能性が公表論⽂にて報告されております(Bercu et al. 2021)。(中略)以上のことから,NDEA を含む N-ニトロソアミンは強⼒な変異原性発がん物質(Cohort of concern)であるものの,ICH M7 で規定される他のクラスの不純物と同様に ICH M7 のLTL のアプローチを適⽤して管理可能と判断しました。
ここだけ読むと、日本国内において、NDEA以外のニトロソアミンでLTLアプローチが適用可能かどうかは読み取れませんでした。何かの機会で詳しく聞いてみたいと思います。
リンクが無効になっていたので貼り直しました。
日本の皆様 こんにちわ
Lhasaの日本チームにウェビナーを教えてもらったので、共有します。
昨年の11月くらいにあったウェビナーに、日本語字幕を付けたものっぽいです。
“How to predict for the formation of NDSRIs (in Japanese)”
2024年4月23日15:00(JST)
“How to establish acceptable intake limits for NDSRIs (in Japanese)”
2024年5月14日15:00(JST)
興味がある方はぜひご登録ください。
2024年のアンケートの結果と第2回アンケートが届いたので共有します。
<自主点検の進捗状況>
• 混入リスク評価について、8~9割完了し、その内訳は、リスク有り1割、リスク無し7~8割
• 実測を行う品目のうち、実測が完了したのは2~3割
• リスク管理措置について、措置が必要かを検討中の品目が多い
• 現時点で検討されているリスク管理措置としては、原薬や中間体の段階での規格設定、最終製品の出荷規格の設定、添加剤受入時の亜硝酸管理、その他承認書の変更を伴わないものが比較的多く検討されている
<第2回アンケート>
- 自主点検の対象品目数
- 混入リスク評価の結果(品目数:混入リスク有り,混入リスク無し,評価未完了)
- 実測の結果(品目数:実測対象,検出限界以下,限度値の10%未満,10~30%,30~100%,100%オーバー,対応中/未測定)
- リスク管理措置の予定(品目数:規格追加,規格追加(スキップ試験),規格追加以外(一変),規格追加以外(軽微))
I added my rough translation in English. Details are not included but there are some opinions from pharmaceutical companies.
Status of self-inspection (results of questionnaire).pdf (453.0 KB)
日本の皆様 こんにちは
日本PDAの技術教育委員会シンポジウムに参加しました。規制当局の方や企業のエキスパートの方からニトロソアミン問題について具体的なお話が聞ける、非常に素晴らしい機会だったと思います。
ご参考までに、主なQ&Aを雑にまとめたので共有します。あくまでも自己責任でお取り扱いください。
なお,正式なものは別途公開されると思います。
Q.日本のエンタカポンの例では、NDEAにLTLアプローチを用いて暫定限度値を定めているが,これはNDEAだからか? 他のNDSRIでもLTLアプローチを適用可能か?
A.エンタカポンは10年以上使用されることがない医薬品だからである。他のNDSRIでも使用期間が限られている場合は,LTLを適用可能と考える。相談してほしい
Q.日本国内では、メトホルミン以前と令和3年以降の回収事例で、回収のクラスが1から2に変わったが厚労省の考え方に何か変化があったのか?
A.状況がわかってきて,その時その時で適切に判断した結果,以前はクラス1だったものが最近はクラス2となっているとの認識。
Q.資料にニトロソアミンの生成リスクは亜硝酸塩濃度の2乗に比例するとあるが,文献はあるか?
A.ある、引用元の文献を参照してほしい。
Q.ICH M7のrevisionについて,差しさわりの無い範囲でScopeを教えてほしい。
A.ニトロソアミンのAddendumが出て,6月の福岡会議で議論される予定。最終化するまでには時間がかかると思う。
Q.開発段階における、ニトロソアミンへのLTL適用は認められるか?
A.EMAは認めていない。
A.日本国内では議論の余地はあると考えている。どうしようもなければ相談してほしい。
A.現在,HESIで議論中。問題ないと思われるデータもあるので,適用可能となることを期待している。
Q.限度値が低すぎて分析ができない場合はどうすればいいか?
A.今まで分析不可能であった事例があるとは聞いていない。そういったものはないと考えている。
A.CPCAにより高い許容限度値を設定できるようになったが,それでも40%はカテゴリー1, 2である。分析で問題になることはありうると考える。リードアクロス法を用いる等の対応が必要。
A.自社で分析できない場合は国衛研等,他者に協力を求める。
Q.メトホルミン以外で、大気中のNOxガスが問題となってニトロソアミンが混入した事例はあるか?
A.これまで回収となった事例は知らないが,生成リスクの一つとして十分に留意してほしい。
A.現在検討中。結果が出るまでに時間がかかる。リスクとしては十分にありうると思う。
Q.メトホルミンの事例以降,包装資材が原因で実際にニトロソアミンが混入した事例はあるか?
→最近の事案については聞いてない。ニトロセルロースフリーの包材への入れ替えについてもホットトピックとはなっていないという認識。
Q.ICH M7ではAmes試験陰性によりICH Q3A/Bでの管理となるが,ニトロソアミンではEAT陰性でもTTC(1500 ng/day)の管理としかできない理由は何か?
A.ポテンシーが高いから。
A.ニトロソアミンのポリシーはICH M7のレベルでは適用できなくなっている。非臨床の専門家は,Ames試験で陰性でもin vivo試験で陽性になるかもしれないと言っている。ICH M7内でもっと議論すべきと考える。
I am not sure that I have ever seen this written down before…
Do you have a link please @Yosukemino ?
Dear MarKs,
I found an article about the rate of nitrosation.
Formation of N -Nitrosamine Drug Substance Related Impurities in Medicines: A Regulatory Perspective on Risk Factors and Mitigation Strategies
https://pubs.acs.org/doi/10.1021/acs.oprd.3c00153
With respect to the N-nitrosamine formation rate, since the amine nitrosation rate under conditions most pertinent to drug product manufacturing is generally proportional to the square of [NO2–], (23,67) a 10-fold reduction in nitrite concentration would theoretically lead to a 100-fold reduction in nitrosation rate.
Best regards
Yosuke
私のインタビュー記事が日刊薬業に掲載されましたので、ご報告します。
ニトロソアミン、リスク評価はまだ途上 26社勉強会・美濃代表、海外情報共有で後押し
大体以下のようなことが書いてあります。
・主催しているニトロソアミンの勉強会について 海外の識者に講演を依頼して、理解を深めている
・アンケートの結果では8~9割のリスク評価が完了したとあるが、残り1~2割でも日本の医薬品の総数を考えればかなりの数が残っており、それらは評価が難しいものと思われる
・海外ガイダンスが頻繁に更新されており、タイムリーにキャッチアップするのが難しい
・先行して規制を導入した欧米でもいまだ課題を抱えている
・添加剤業者からうまく情報が得られないのも未だ大きな課題
・終息までまだ数年かかりそう。
・海外主導でNDSRIに対する緩和措置がいろいろ検討されているので、日本でも実用化されることを期待している
続いて日刊薬業のニトロソアミン問題の解説記事です。
対応期限迫るニトロソアミン 残り5カ月も課題山積(24/05/27)
発がん性物質ニトロソアミン類の医薬品への混入について、厚生労働省が2021年10月に製薬各社に求めた大規模自主点検の最終期限まで残り5カ月となった。厚労省が先月公表した調査では、「混入リスクあり」が2000品目近くあったが、そのうち限度値を超えているかを調べる実測は2~3割しか完了しておらず、対応に苦慮している状況がうかがえる。
以下要点を記載します。
・回答数は医療用約1万3000品目(約190社)、OTC約3700品目(約130社) 合わせて約1万6700品目(約320社)。リスク評価が完了したのは8~9割(医療用約1万1000品目、OTC約3000品目)。
・Step1で「混入リスクあり」と判定されたのは約1割(医療用約1600品目、OTC約350品目)。
・Step2で分析が完了したのは2~3割(医療用約400品目、OTC約70品目)。逆に言うと7~8割(医療用約1200品目、OTC約280品目)が未完了。
・完了していない主な理由:
*分析機器・技術者が足りない
*試験委託施設も足りない
*標準品の合成や入手が困難
*測定費用が高額
*分析法の開発が困難
・期限の延長については、各社10月末の完了を目指したうえで、それでも難しい場合は対応を検討したいとのこと
続いて、本日の日刊薬業の記事です。詳しくは記事を読んでください。
ニトロソアミンGL、ICHの新トピックに 福岡会合で提案、規制調和目指す
来月1日に開幕する医薬品規制調和国際会議(ICH)福岡会合で、発がん性物質ニトロソアミン類の医薬品への混入問題に対応するためのガイドライン(GL)策定が新規トピックとして提案される見通しだ。採択されれば、日米欧をはじめとする加盟国間で共通するGLを作り、規制の調和を図る。
以下、要点を列挙
・ICH M7ではニトロソアミンをcohort of concernの1つに位置付けているが、許容摂取量の詳細な設定方法は記載されていない
・欧米のニトロソアミンガイダンス間で差がある
・M7の補遺として発行予定 GL策定に当たっては、許容摂取量などが議論のポイントになるとみられる
・規制が調和されれば、グローバル展開する企業は、それぞれの国の規制に合わせて異なる対応をしなくても済む
Important development on ICH M7 to address Nitrosamines
@trust_user_a @Nitrosamines_Analyzer @trust_user_c @trust_user_d
2024年6月7日の日刊薬業の記事をご紹介します。ニトロソアミン混入発覚時のリスクコミュニケーションのガイダンス案です。
ニトロソアミン混入、情報提供を迅速化 厚労省研究班ガイダンス案、全製薬企業に適用へ
以下、記事からの抜粋
具体的な手順としては、 自主点検通知のQ&Aを参考に厚労省に報告を行い、医薬品医療機器総合機構に「製造販売業者からの案内文書」のホームページへの掲載を依頼する。厚労省に報告し措置内容が決定したら、医療機関への情報提供文書の作成を行う。臨床的位置付けや代替品の有無などにより影響が大きいと考えられる場合はプレスリリースや患者向け説明資料の作成、コールセンターの設置も検討する。 さらに関連学会などにも情報提供し、医療関係者への周知に関する協力を相談することが望ましいとしている。
情報提供文書について:
背景や検出されたニトロソアミンの名称のほか、想定される健康への影響や当該製剤に対する措置を含める。想定される健康への影響では、検出されたニトロソアミンについて、変異原性・発がん性の有無(不明を含む)や1日許容摂取量(AI)、測定結果がAIを超えていたかどうかを示す。
測定結果がAIを超えていたかどうかの 記載例としては、「理論上の発がんリスクは、およそ〇万人に1人が過剰にがんを発症する程度のリスクに相当」 「今回検出された値はこの許容摂取量と比べて最大〇倍高い」 ―の2点を掲げた。
当該製剤に対する措置 では、▽製品の出荷継続の可否(回収の有無)とその理由 ▽過去に服用した患者のリスク ▽現在服用している患者の処方の中断・継続に関する推奨事項▽今後の供給の見通し―を記載する。
ガイダンス案はこちらです。情報提供文書のモデル案もあります。
2024年6月5日にあった、第8.5回 ニトロソアミンのリスク評価に関するグループ討議(オンライン)での情報を共有します。
参加者:140名以上
1部:ニトロソアミンのリスク評価・管理 基礎編の講演(Yosuke.Mino)(約1時間)
内容はニトロソアミン混入問題の背景、EMAガイダンス解説、EFPIA Workflow解説、現在の課題について
2部:Q&A(約1時間)
以下、参加者からの質問を列挙します。
Q1. 一級アミンはニトロソアミン評価の対象外か?
Q2. 三級アミンの反応性は低いが,四級アミンについてはどうか?
Q3. EFPIAのデシジョンツリーの考え方は当局に受け入れられるか?
Q4. 抗酸化剤が入った処方を,EFPIAの混入量予測計算に反映させるにはどうすればよいか?
Q5. 医薬品企業は実際にEFPIAのデシジョンツリーによる計算をどれくらい行っているか?
Q6. 予測値を計算するにあたって、添加剤中の亜硝酸塩量は重要なファクターとなるが,この情報が得られない場合はやはり自社での測定が必要か?
Q7. 業界内で添加剤業者や添加剤の情報共有をするというような枠組みは存在しないのか?
Q8. FDAはNDSRIに対して評価期限を延長しているが、日本国内では期限延長の話はないか?
Q9. 4月にアンケート結果が公開されたが,いまだ製薬企業の声は集約されていないという認識か?
Q10. 国内にEnhanced Ames Testが実施できる試験委託施設はあるか?
Q11. 原薬がアミドの場合,加水分解して生成する不純物量の二級アミンについて,如何にリスク評価すべきか?
Q12. ニトロソアミンはICH M7のCohort of concernに該当するが,開発段階でどこまで対応するのが適切か?
Q13. 分析に進む必要がある医薬品をできる限り絞り込むべく,予測値の計算が重要と考えるが、TIPSがあれば教えてほしい。
Q14. ICH M7でのニトロソアミンの取り込みはどのようになるのか?
日本国内において、ニトロソアミン混入のリスクコミュニケーションガイダンスが公開されたのでお知らせします。
以下の内容が記載されています。
報告先:厚生労働省、PMDA、医療機関等、関係学会
情報提供すべき内容:混入しているニトロソアミンの種類、許容限度値、健康への影響評価、今後の対応(回収の有無、服用者への推奨事項、今後の供給について等)
また情報提供文書の記載例も付いています。
私がAI翻訳で作成した英語版もつけておきます。
Risk communication in Japan.pdf (116.1 KB)
Lhasa Japan Symposium, 2024についてお知らせします。
日時: 2024年 9月10日 9:30-18:00 (Networking: 18:00-19:00)
場所: 東京
同時通訳あり
Session1: In silico を用いたICH M7評価(~昼まで)
Session2: ニトロソアミンのリスク評価(昼~夕方)
Session3: ニトロソアミンに関するEMAからの規制助言(夕方~)
+Q&A
Draft agendaは以下のようになっています。
私は日本におけるニトロソアミンのリスク評価の現状について講演予定です。
皆様にお会いできるのを楽しみにしております。
Dear Yosuke,
thanks for sharing this, it looks very interesting
two questions
this is only live workshop or we can join this also on-line?
and if i understood well, this is free of registration charge, correct?
kind regards
Christos

